免疫印迹是利用聚丙烯酰胺凝胶电泳来检测特定样品或提取物中某种特定蛋白的方法。聚丙烯酰胺凝胶紧贴着膜放置,常用的膜 是硝酸纤维素或 PVDF(聚偏乙烯氟化物),在电流的作用下蛋白质从凝胶迁移到膜上并且被固定。膜是凝胶蛋白质的复制品,然 后可以与抗体结合后进行染色。
下面的免疫印迹模式图包括样品准备、凝胶电泳、凝胶到膜的转移以及检测蛋白的免疫染色。根据使用的电泳和转移设备,实验 方案需要优化,建议读者参照厂家的说明书。
蛋白质印迹
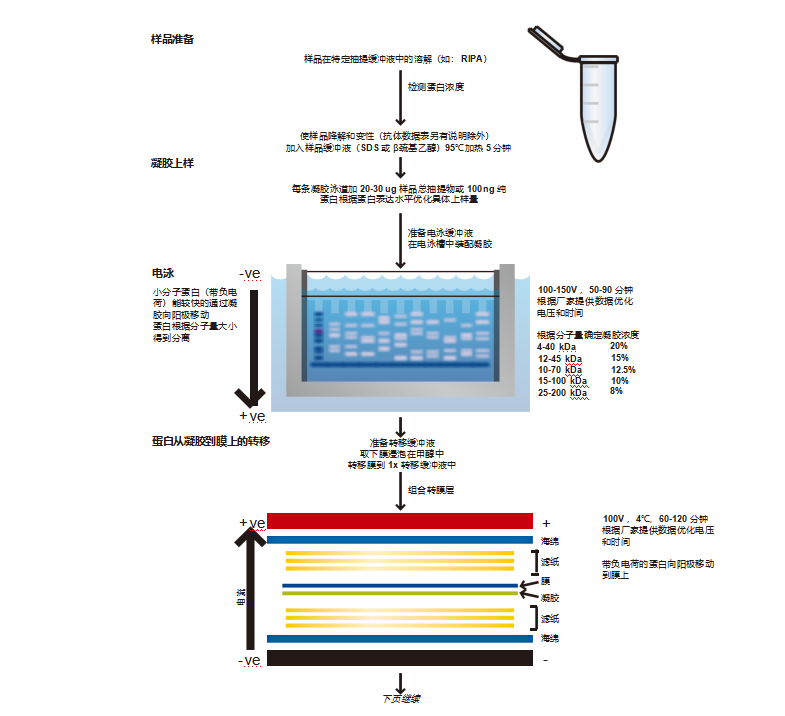
蛋白质印迹(继续)
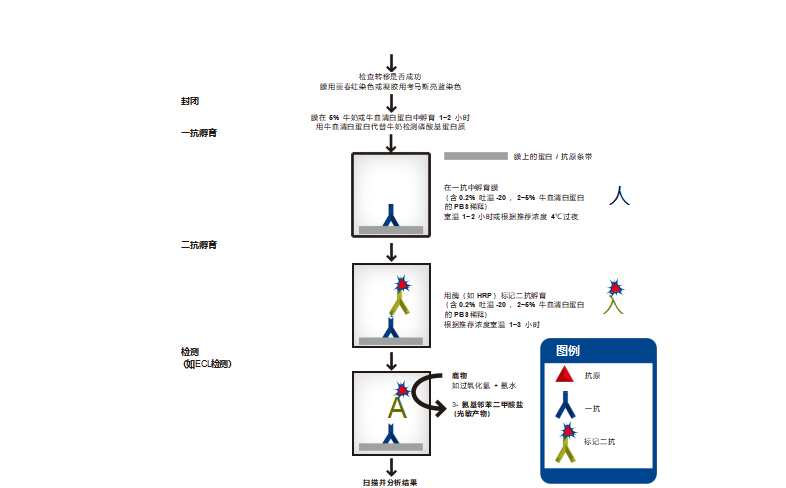
5.1. 样品准备
裂解缓冲液
准备凝胶电泳的样品,需要对细胞和组织进行裂解以释放目的蛋白,这些可溶性蛋白能够穿过分离胶单独移动。裂解缓冲液有很 多种,但用来做 WB 试验的仅有少数几种。简单来说,它们溶解蛋白的能力不同,含有十二烷基硫酸钠和其他离子型去污剂的溶 解能力最强。
大部分启研 抗体能够识别降解和变性蛋白质,因此应该在降解和变性条件下使用该类抗体。需要注意的是一些抗体仅仅识别 天然的、非变性蛋白质,故不能识别经去污剂(SDS、脱氧胆酸盐、弱降解作用的 Triton X-100 和 NP40)作用的蛋白质。选择裂解缓冲液首先要考虑选择的抗体是否识别变性的样品。如果不能,有关资料会列在抗体说明书上,应该使用不含去污剂的 缓冲液或者是相对温和的非离子型缓冲液(NP-40,吐温 X-100)。
蛋白定位和裂解液的选择
关于缓冲液的配方请参照 71 页缓冲液章节十一。
|
样品类型 |
裂解液 |
|
全细胞 |
NP-40 或 RIPA |
|
细胞质(可溶性的) |
Tris-HCI |
|
细胞质(细胞骨架) |
Tris-Triton |
|
膜结合部分 |
NP-40 或 RIPA |
|
细胞核 |
RIPA 或核裂解液 |
|
线粒体 |
RIPA 或线粒体分离方案 |
* 专门或主要表达在亚细胞结构区域的蛋白在亚细胞裂解物中比在全细胞和组织裂解物中更为富集。这对于提取弱表达蛋白非常 重要。例如,相对于全细胞或全组织裂解物来说,核表达蛋白在细胞核裂解物总蛋白中占有相当大的比例,这样凝胶条带中可以 载入更多的目的蛋白。另一个优点是排除了杂质成分潜在的交叉反应。请参考我们的亚细胞结构分离技术方案。
Nonlidet-P40(NP40)缓冲液
这是研究细胞质蛋白、膜结合蛋白或者全细胞抽提物等常用的一种缓冲液。如果目标蛋白不能完全从不溶性或凝集物中提取, RIPA 缓冲液将会更合适,它包含的离子型去污剂能更好溶解蛋白。
RIPA 缓冲液(放射免疫沉淀分析缓冲液)
这种缓冲液对全细胞提取物和膜结合蛋白都非常有用,对提取细胞核蛋白来说,这种缓冲液比只含有 NP40 或 Triton X-100 的缓 冲液更受欢迎。但它会破坏蛋白与蛋白之间的相互作用,因此这在免疫沉淀测定中会有些问题。
在需要保存蛋白与蛋白相互作用,或者将蛋白变性降到最低(例如,抗体只能识别一个非变性表位)时,应该使用不含离子型去 污剂(SDS)的缓冲液和不含非离子型去污剂(Triton X-100)的缓冲液。用不含去污剂的裂解液,一般需配合机械剪切来裂解细 胞,常用的 Dounce 均浆器或者将细胞反复通过注射器针头。这时简单的 Tris 缓冲液就足够了,但是对于膜结合蛋白或细胞骨架 蛋白则需要含有去污剂的缓冲液。
蛋白酶和磷酸酶抑制剂
一旦裂解发生,水解、去磷酸化和变性就开始了。如果样本在冰上或始终在 4°C 存放以及一开始就往裂解液中加入适当抑制剂 的话,这些反应将可以大大减缓。
混合(“鸡尾酒”)的蛋白酶和磷酸酶抑制剂已经商品化,也可以自己研制抑制剂的配比。
|
抑制剂 |
蛋白酶或磷酸酶 |
在裂解液中的终浓度 |
贮备液(保存在 -20°C) |
|
抑酶肽 |
胰岛素、胰凝乳蛋白酶、 血纤维蛋白溶酶 |
2μg/ml |
水稀释至 10mg/ml 一旦融化不能再使用 |
|
亮肽酶素 |
溶酶体 |
5-10μg/ml |
水稀释,一旦融化不能再使用 |
|
抑肽素 A |
天冬氨酸蛋白酶 |
1μg/ml |
甲醇稀释,1mM |
|
苯甲基磺酰氟化物 (PMSF) |
丝氨酸半胱氨酸蛋白酶 |
1mM |
乙醇稀释,可重复使用 |
|
乙二胺四乙酸(EDTA) |
需要 Mg++ 和 Mn++ 的 金属蛋白酶 |
5mM |
水稀释至 0.5M 调节 pH8.0 |
|
乙二醇双 (2- 氨基乙醚 ) 四乙酸(EGTA) |
需要 Ca++ 的金属蛋白酶 |
1mM |
水稀释 0.5M 调节 pH 8.0 |
|
氟化钠 |
丝氨酸 / 苏氨酸磷酸酶 |
5-10mM |
水稀释,一旦融化不能再使用 |
|
原钒酸钠 |
酪氨酸磷酸酶 |
1mM |
水稀释,一旦融化不能再使用 |
原钒酸盐准备
所有步骤均在通风橱中进行。
1. 用双蒸水溶解原钒酸钠至 100mM。
2. 用盐酸调 pH 值至 9.0。
3. 加热至无色。为尽量减少由于蒸发所致体积减小,加热时加盖。
4. 冷却至室温。
5. 调 pH 值至 9.0。
6. 再次加热至无色。
7. 再次加热冷却重复以上循环直至加热冷却后溶液 pH 值保持在 9.0。
8. 用水补至起始体积。
9. -20°C 分装保存,若变黄则废弃。
细胞培养裂解物的制备
1. 将细胞培养皿放置冰上并用冰冷的 PBS 洗涤细胞。
2. 吸干 PBS 后,再加入冰冷的裂解液(每 107 细胞 / 100mm2 培养皿 /150cm2 培养瓶加 1ml,每 5x106 细胞 / 60mm2 培养皿 / 75cm2 培养瓶 加 0.5ml)。
3. 用预冷的塑料细胞刮刀将贴壁细胞从培养皿上刮下,然后轻轻将细胞悬液转移到预冷的小离心管中。
4. 4°C 持续振荡 30 分钟。
5. 4°C 预冷微型离心机中 16,000 x g 离心 20 分钟。
6. 从离心机中轻轻地取出离心管放置在冰上。将上清液吸出转移到预冷的新管(放在冰上)中,弃沉淀。
组织裂解物的制备
1. 用干净器械解剖所需的组织,最好在冰上,并快速操作以防止蛋白酶降解。
2. 将组织放入圆底离心管或 Eppendorf 管中,浸入液氮中“速冻”。样本在 -80°C 储存备以后使用或放在冰上立即匀浆。
对于约 5mg 组织,向管中迅速加入约 300μl 裂解液并用电动匀浆器均浆,裂解液冲洗刀片两次,每次 300μl,然后 4°C 持续振 荡 2 小时(将 回旋振荡器放入冰箱)。裂解液的体积根据组织总量来决定。蛋白提取物不宜过于稀释,以避免蛋白质损失,并尽 量减少样品体积以便凝 胶上样。最小浓度为 0.1mg/ml;最佳浓度为 1-5mg/ml。
3. 微型离心机 4℃ 16,000rpm 离心 20 分钟。从离心机中轻轻地取出离心管放置在冰上。吸出上清液放入预冷的新管(放在冰上) 中,弃沉淀。
|
缓冲液(含抑制剂)在匀浆前需预冷。 |
蛋白质浓度的测定
用 Bradford、Lowry 或 BCA 方法测定蛋白质含量,牛血清白蛋白是常用的蛋白标准。
一旦确定了每管的蛋白浓度就可以在 -20°C 或 -80°C 冷冻样品备用,或为免疫沉淀反应或凝胶上样做准备。
凝胶上样:变性的和天然的,还原的和非还原的
a) 变性、还原样品
抗体特异性识别目标蛋白的部位(即抗原表位)可能存在于蛋白的三维构型内部。为了能使抗体接近抗原表位,必须将蛋白的三 维构型打开,即使蛋白变性。
要使蛋白质变性,使用含阴离子变性去污剂十二烷基硫酸钠 (SDS) 的上样缓冲液,95-100°C 煮沸 5 分钟,或者在 70°C 加热 5-10 分钟,尤其是研究跨膜蛋白时,因为煮沸更易聚集,聚集物不能有效的进入胶中。
标准品上样缓冲液叫做 2 倍 Laemmli 缓冲液,最初描述在《自然》杂志上(1970 Aug 15;227(5259):680-5.)。也可以用 4 倍和
6 倍的样品缓冲液,可以减少缓冲液对样品的稀释。2 倍的样品缓冲液和样品以 1:1 的比例混合。
使用 SDS,通过 SDS 阴离子的粘附作用,所有的蛋白质都带负电荷,SDS 通过“缠绕”多肽链使蛋白变性。SDS 以 1.4:1 的比例 结合到蛋白上,SDS 赋予多肽的负电荷数与蛋白的长度成比例,即变性的多肽成为负电荷云的“棒”,每一单位长度的多肽带有 相同的电荷数或电荷云密度。
在变性 SDS-PAGE 中,迁移率不是由多肽固有的电荷数目来决定,而是由多肽的分子量来决定。SDS 的纯度尤为重要,蛋白质被 染色的背 景与蛋白条带能显示出 SDS 质量的好坏。
通过加入 β 巯基乙醇或二硫苏糖醇(DTT),按照分子量大小进行分离,在蛋白形成自由弯曲之前减少二硫键的形成是非常必要的。 上样缓冲液中加入甘油能增加样品的密度,使样品停留在样品池的底部,防止外溢和使凝胶上样不规则。
为了能看到蛋白的迁移,通常在上样缓冲液中加入小分子的离子型染料(如溴酚蓝)。染料在混合物中的迁移速度最快,能够提 供一个迁移前沿来监测分离的过程。
凝胶可以商业购买或在实验室自己制备(配方可以在实验室手册上找到)。胶凝体的百分比对蛋白质迁移率和分离度至关重要。
|
拇指原则:目标蛋白分子量越小,mono/bis 百分比越高;目标蛋白分子量越大,mono/bis 的百分比越低。 |
|
蛋白大小(kDa) |
凝胶百分比(%) |
|
4-40 |
20 |
|
12-45 |
15 |
|
10-70 |
12.5 |
|
15-100 |
10 |
|
25-200 |
8 |
丙烯酰胺是潜在的有累积作用的神经毒素 :操作时要一直佩戴手套。 按照厂家说明将凝胶放在电泳槽中并且浸泡在电泳缓冲液中。
阳性对照
阳性对照裂解物用来表明试验是有效的并且是正确的,及可证明目标蛋白不在样本中表达。
|
当设定一个新实验时,我们强烈推荐使用阳性对照裂解物,这将提高试验的可信度。 |
分子量标准
上样和跑凝胶
使用特定的凝胶上样吸头或微型注射器在狭窄的样品池中加入全部样品,注意不要用尖头刺破池的底部,否则会形成扭曲的条带。 不要过度填充样品池,如果样品溢入旁边的样品池,将会影响结果。每个样品池装载 20-40μg 蛋白。
将凝胶浸泡在电泳缓冲液中,这些缓冲液通常包含 SDS,天然的凝胶电泳除外。
一个标准的 PAGE 电泳缓冲液,又叫运行(running)缓冲液,是 1× 氨基乙酸 - 甘氨酸(参见第 71 页的缓冲液章节)。 跑凝胶时按照厂家推荐的时间进行,这些可以随着仪器的改变而变更(根据电压,1 小时至过夜)。
当染料分子(“迁移前沿”)到达凝胶的底部,关闭电源。此时蛋白会从凝胶上慢慢的洗脱,因此不要保存在凝胶里,要迅速进 行下一步的转移操作。
5.3. 蛋白转膜和染色 凝胶内蛋白的显色
蛋白显色的阶段非常重要,可以知道蛋白迁移的是否均匀、平坦。如果分离后的蛋白需要转膜,就用铜染,因为考马斯蓝染色是 不可逆的。考马斯蓝染色只用来检测转移的有效性,或者蛋白不需要转膜时,只用于观测蛋白 SDS-PAGE 分离的结果。
a) 考马斯蓝染色
电源关闭,分离的蛋白带就会扩散,因为蛋白在溶液中是可溶的,为了防止扩散,凝胶中加入 40% 双蒸水、10% 醋酸、50% 甲 醇,能使蛋白质沉淀(变成不溶性的)。在上述溶液中加入 0.25% 考马斯亮蓝 R-250 使被固定的蛋白染色,在摇床上保持摇动, 室温,4 小时至过夜。转移凝胶至 67.5% 双蒸水、7.5% 醋酸、25% 甲醇混合物中(染料混合物保存起来,可多次重复使用)润 洗,一直在摇床上震摇,中间更换润洗液,直到洗去多余染料。染料不会结合到丙烯酰胺上,凝胶背景清晰,凝胶中的蛋白条带 染成深蓝色。
b) 铜染法
电泳凝胶用蒸馏水清洗数秒钟(最多 30 秒),然后转移至 0.3 M CuCl2 溶液中染色 5-15 分钟,再用去离子水洗一次,在暗背景 下观察,在蓝色胶背景下蛋白出现透明条带。
将胶置于 0.1- 0.25 MTris/0.25 M EDTA pH 8.0 缓冲液中漂洗凝胶完全脱色,根据厂家说明再置于电转缓冲液中开始转膜。
蛋白转膜
1. 详细的转膜操作可以在电转仪厂家的网页上找到,不同的系统操作也有区别。蛋白从凝胶至膜的转移应用的原理是电荷在电场 中的迁移。
2. 转膜方式分为半干转移和湿转移两种,半干式转膜速度快,而湿式转膜不会因为膜的干燥而失败,因此成功率高并特别适合用 于分子量大 于 100kDa 的蛋白。两种转膜方式都是膜紧贴凝胶,位于两层吸收材料之间,固体夹板夹在外面以保证膜和凝胶的紧 密接触。
3. 湿式转膜中膜和凝胶的三明治结构位于滤纸和海绵体之间(海绵/纸/胶/膜/纸/海绵),全部紧密排列,特别是胶/膜之间不能 留有气泡。整 个三明治结构浸泡在转移缓冲液中,然后施加电场。带负电荷的蛋白向阳极移动。但膜阻挡了它们,并与其进行结 合,从而阻止了它们的继续移动。凝胶一般在 100V 条件下运行 1~2 小时,时间和电压可以优化,我们推荐根据厂家的说明进行 操作。
.png)
4. 标准的湿转缓冲液和电泳缓冲液一样,为不含 SDS 的 1X Tris-gly 缓冲液,加入甲醇至终浓度 20%。如果转膜的蛋白分子量大 于 80kDa,则推荐加入 SDS 使之终浓度为 0.1%。
5. 半干式转膜中,三明治结构纸/凝胶/膜/纸用转移缓冲液浸湿,直接置于电转仪的正负极之间。在进行转移时,要注意一定要 使膜紧贴阳极而胶紧贴阴极。所用的电转缓冲液中 Tris 和甘氨酸的比例不一定和湿转的相同,需参考厂家的仪器说明书。标准配 方是:48mMTris、39mM 甘氨酸、0.04% SDS、20% 甲醇。
6. 两类膜可供选择:硝酸纤维素膜和 PVDF 膜(正电荷尼龙膜)。PVDF 膜需要小心地进行前处理:剪出大小合适的膜,在甲醇 中浸泡 1-2 分钟,再孵育于冰冷的电转缓冲液中 5 分钟。胶也需在冰冷的电转缓冲液中平衡 3-5 分钟,否则转膜时会起皱导致 条带变形。
大蛋白和小蛋白转膜时的注意事项
电转移缓冲液中 SDS 与甲醇的平衡、蛋白大小、胶浓度都会影响转膜效果,如下调整可以增加转膜效果。 大蛋 白(大于 100 kDa)
1. 对于大蛋白而言,其在凝胶电泳分离迁移较慢,而从凝胶转出也非常慢,因此对于这种大分子量蛋白应该用低浓度的凝胶,8% 或更低,但因低浓度的胶非常易碎,所以操作时需十分小心。
2. 大蛋白易在凝胶里形成沉淀,从而影响转膜。转膜时在电转移缓冲液加入 SDS 至终浓度 0.1%,避免出现这种情况。甲醇易使 SDS 从蛋白上脱失,因此相应降低甲醇的浓度至[ 相关下载 ]
