缓冲液和试剂
通常将未知浓度样品与阳性对照标准曲线相比较,可精确定量。每块板都要带标准(做平行或者三份)和空白对照以保证精确性。
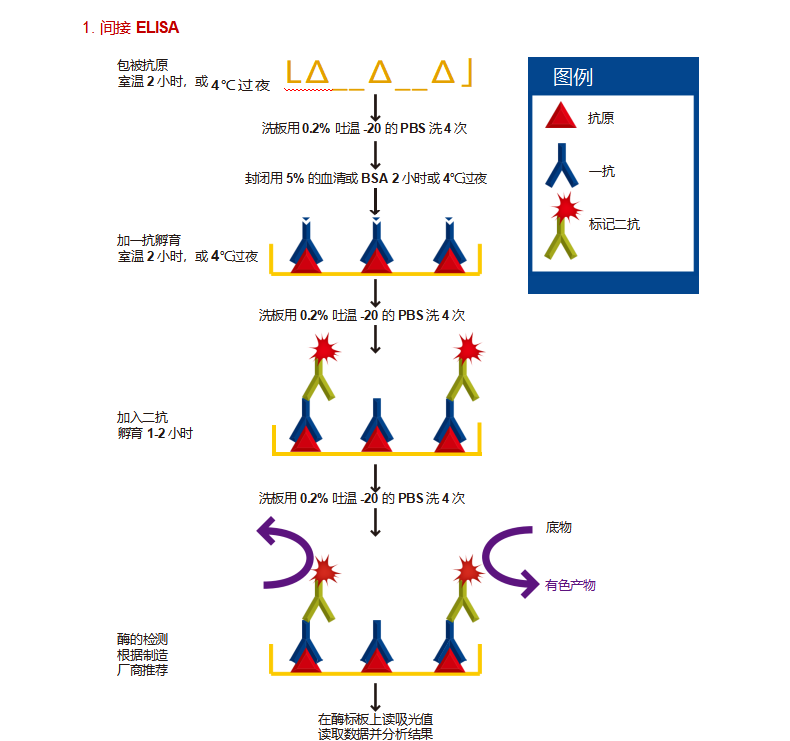
常规程序 包被抗原
1. 用 PBS 或碳酸盐缓冲液稀释抗原至终浓度 20μg/ml。用吸管吸取 50μl 稀释抗原到 PVC 微孔板上的第一排孔,按要求往后进行 系列稀释。
|
样品纯度较高时通常在酶标板上稀释到不低于 2μg/ml。 不一定用纯化的溶液,不过,一般在试验样品中目的蛋白(抗原)含量需大于 3%。 抗原的蛋白浓度在酶标板上应该不高于 20μg/ml,此时已经足够中和酶标板上的位点了。 确保抗原的浓度在抗体可以检测到的范围内。 |
2. 在酶标板上覆盖封口膜,室温孵育 2 小时,或者 4°C 过夜。包被的孵育时间需要优化。
3. 倒掉孵育溶液,用 PBS 每孔 200μl 洗板 3 次。在水池上轻甩倒掉洗液,在纸巾上轻拍酶标板除去残留液体。 封闭
4. 用 200μl 含 5% 脱脂奶粉或含 5% 血清的 PBS 缓冲液封闭酶标板上剩余的蛋白结合位点。或者用其他封闭剂如 BlockACE、BSA (牛血清蛋白)代替。
5. 用封口膜覆盖酶标板室温至少孵育 2 小时,或者 4°C 过夜。
6. 用 PBS 洗板 2 次。
加一抗和二抗进行孵育
7. 每孔加入 100μl 稀释好的一抗。
8. 用封口膜覆盖酶标板室温孵育 2 小时,该孵育时间需要进行优化。尽管 2 小时的孵育通常可以获得足够强的信号,但如果获得的 信号较弱时,通过 4°C 孵育过夜通常可以获得较强信号。
9. 用 PBS 洗板 4 次。
10. 加 100μl 标记二抗,稀释到最佳浓度(参照说明书),使用前用封闭液现配。
11. 用封口膜覆盖酶标板室温孵育 1-2 小时。
12. 用 PBS 洗板 4 次。
检测
虽然许多种类的酶都可以用来检测,但辣根过氧化物酶 (HRP) 和碱性磷酸酶 (AP) 在 ELISA 实验中是被广泛应用的两种酶。我们 必须要考虑到一些生物原料本身具有很高水平的酶活性(例如肺泡细胞中高含量的 AP,红血球中高含量的过氧化物酶),这可能 导致不精确的结果。如果有必要的话,用左旋咪唑(针对 AP)或含 0.3% 双氧水溶液的甲醇(针对过氧化物酶)进行一个附加的 封闭处理。
AP 底物
pNPP(对硝基苯基磷酸盐)是最广泛使用的底物。室温下孵育 15-30 分钟后,硝基酚的黄颜色可以在 405nm 下被检测出(这一反 应可以通过加入适当量的 0.75M 氢氧化钠溶液来终止)。
HRP 显色剂
HRP 的底物是过氧化氢,反应中,过氧化氢分裂使氢供体氧化产生颜色变化。
TMB (3,3’ ,5,5’ - 四 甲基对二氨基联苯 )
加 TMB 溶液至每孔,孵育 15-30 分钟,加相同分量终止液(2M 硫酸),在 450nm 下读取吸光度值。
OPD ( 邻苯二胺盐酸盐 )
终产物在 492nm 下检测。需要注意的是这种底物对光敏感,因此需要避光保存。
ABTS (2,2’ - 连氮 - 二 (3- 乙基苯并噻唑啉 -6- 磺酸 ) 磷酸氢二铵盐 ) 终产物是绿色的,在 416nm 测定吸光度值。
|
注意:一些酶底物是有害的(致癌物),因此必须小心操作并佩戴手套。 |
13. 用多通道吸液器向每孔加入 100μl(或 50μl)底物。
14. 显示出足够深的颜色之后,再向每孔加终止液 100μl(如果必须)。
15. 用酶标仪读每个孔的吸光度值(光密度)。
数据分析
根据连续稀释的数据制作一条标准曲线,x 轴为浓度(对数转换),y 轴为吸光度值(线性)。将样品吸光度值代入标准曲线求出浓度。
1. 直接 ELISA 操作步骤
常规程序
包被抗原
1. 用 PBS 或碳酸盐缓冲液稀释抗原至终浓度 20μg/ml。用吸管吸取 50μl 稀释抗原到 PVC 微孔板上,按要求往后进行系列稀释。
|
样品纯度较高时通常在酶标板上稀释到不少于 2μg/ml。 不一定用纯化的溶液,不过,一般在试验样品中目的蛋白(抗原)含量需大于 3%。 抗原的蛋白浓度在酶标板上应该不高于 20μg/ml,此时已经足够中和酶标板上的位点了。 确保抗原的浓度在抗体可以检测到的范围内。 |
2.在酶标板上覆盖封口膜,室温孵育 2 小时,或者 4°C 过夜。包被的孵育时间需要优化。
3.倒掉孵育溶液,用PBS 每孔 200μl 洗板 2 次。在水池上轻甩倒掉洗液,在纸巾上轻拍酶标板除去残留液体。 封闭
4. 用 200μl 含 5% 脱脂奶粉或含 5% 血清的 PBS 缓冲液封闭酶标板上剩余的蛋白结合位点。或者用其他封闭剂如 BlockACE、BSA (牛血清蛋白)代替。
5.用封口膜覆盖酶标板室温至少孵育 2 小时,或者 4°C 过夜。 6.用 PBS 洗板 2 次。
加抗体孵育
7.加入 100 μl 抗体,稀释到最佳浓度(参照说明书),使用前用封闭液现配。
8. 用封口膜覆盖酶标板室温孵育 2 小时,该孵育时间需要进行优化。尽管 2 小时的孵育通常可以获得足够强的信号,但如果获得 的信号较弱时,通过 4°C 孵育过夜通常可以获得较强信号。
9.用 PBS 洗板 4 次。
检测
10.用多通道吸液器向每孔加入 100μl(或 50μl)底物。
11.显示出足够深的颜色之后,再向每孔加终止液 100μl(如果必须)。 12.用酶标仪读每个孔的吸光度值(光密度)。
|
注意:一些酶作用物是有害的 ( 致癌物 ),因此必须小心操作并佩戴手套。 |
数据分析
根据连续稀释的数据制作一条标准曲线,x 轴为浓度(对数转换),y 轴为吸光度值(线性)。将样品吸光度值代入标准曲线求出 浓度。
3.夹心 ELISA
.png)
夹心 ELISA 用两种抗体协同测定抗原的含量(例如:捕获抗体和检测抗体)。抗原必须包含至少 2 个能被抗体识别的抗原位点才 能被检测,因为至少有 2 个抗体参与到这个试验中。
在夹心 ELISA 中,单克隆抗体和多克隆抗体都可以被用作捕获和检测抗体。单抗识别单一的抗原表位,可以区别抗原的微小差别 使抗原得到更精确地检测和定量。多克隆抗体通常被用作捕获抗体 , 以捕获尽可能多的抗原。
夹心 ELISA 的优势是样品在分析前不需要纯化 , 检测灵敏度高(灵敏度是直接法或间接法的 2-5 倍)。 注意事项:
夹心 ELISA 的步骤很难优化,试验中应使用测试过的配对抗体。这样可以确保在不干扰其他抗体结合的情况下,检测目标蛋白上 相应的不同抗原表位。因此对于没有做过特定测试试验的抗体,我们不能确保我们的抗体可以用于夹心 ELISA。请参阅抗体说明 书有关抗体测定应用的信息。
常规步骤:
包被捕获抗体
1. 用碳酸盐 / 重碳酸盐缓冲液 (pH7.4) 稀释捕获抗体至浓度 1-10μg/ml,包被酶标板。
|
如果使用了没有纯化的抗体(例如 : 腹水或抗血清),可能需要通过提高样品蛋白浓度(试一下 10μg/ml), 来补偿特定抗体数量较低的问题。 |
2. 用封口膜覆盖酶标板,于 4°C 孵育过夜。
3. 倒掉包被液,用 PBS 每孔 200μl 洗板 2 次。在水池上轻甩倒掉洗液,在纸巾上轻拍酶标板除去残留液体。 封闭和加样品
4. 封闭包被后孔内残留的蛋白结合位点 , 每孔加 200μl,含 5% 脱脂奶粉的 PBS 封闭液。
5. 用封口膜覆盖酶标板,室温孵育至少 1-2 小时或者如果方便的话,4°C 孵育过夜。
6. 每孔加 100μl 适当稀释的样品。在精确定量测定时,通常将未知浓度样品与阳性对照标准曲线相比较,每块板都要带标准(做 平行或者三 份)和空白对照以保证精确性。37°C 孵育 90 分钟。
|
对于定量检测,标准品的使用浓度应覆盖抗体结合的大部分动态检测范围。您可能需要优化标准品的浓度使用范围, 以确保得到一个合适的标准曲线。为了精确定量,样品和标准通常做 2 份或 3 份。 |
7. 倒掉样品 , 每孔用 200μl PBS 洗板 2 次。 用检测抗体和二抗先后进行孵育
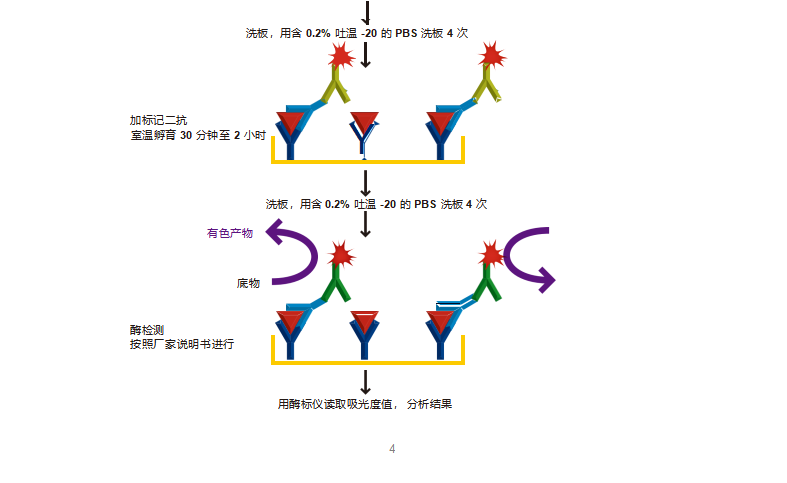
8. 每孔加入 100μl 稀释好的检测抗体。
9. 用封口膜覆盖酶标板,室温孵育 2 小时。
10. 用 PBS 洗板 4 次。
11. 加入 100μl 标记二抗,使用前用封闭液快速稀释至最佳浓度(根据说明书)。
12. 用封口膜覆盖酶标板,室温孵育 1-2 小时。
13. 用 PBS 洗板 4 次。
检测
虽然许多种类的酶都可以用来检测,但辣根过氧化物酶 (HRP) 和碱性磷酸酶 (AP) 在 ELISA 实验中是被广泛应用的两种酶。我们必 须要考虑到一些生物原料本身具有很高水平的酶活性(例如肺泡细胞中高含量的 AP, 红血球中高含量的过氧化物酶),这可能导致 不精确的结果。如果有必要的话,用左旋咪唑(针对 AP)或含 0.3% 双氧水溶液的甲醇(针对过氧化物酶)进行一个附加的封闭 处理。
AP 底物
pNPP(对硝基苯基磷酸盐)是最广泛使用的底物。室温下孵育 15-30 分钟后,硝基酚的黄颜色可以在 405nm 下被检测出(这一 反应可以通过加入适当量的 0.75M 氢氧化钠溶液来终止)。
HRP 显色剂
HRP 的底物是过氧化氢,反应中,过氧化氢分解使氢供体氧化产生颜色变化。 TMB (3,3’ ,5,5’ - 四 甲基对二氨基联苯 )
加 TMB 溶液至每孔,孵育 15-30 分钟,加适量终止液(2M 硫酸),在 450nm 下读取吸光度值。 OPD ( 邻苯二胺盐酸盐 )
终产物在 492nm 下检测。需要注意的是这种底物对光敏感,因此需要避光保存。
ABTS (2,2’ - 连氮 - 二 (3- 乙基苯并噻唑啉 -6- 磺酸 ) 磷酸氢二铵盐 ) 终产物是绿色的,在 416nm 测定吸光度值。
注意:一些酶作用物是有害的 ( 致癌物 ),因此必须小心操作并佩戴手套。
14. 使用多通道移液器每孔加入底物溶液 100μl(或 50μl)。
数据分析:根据连续稀释的数据制作一条标准曲线,x 轴为浓度 ( 对数转换 ) ,y 轴为吸光度值 ( 线性 )。将样品吸光度值代入标准 曲线求出浓度。
1. ELISA 疑难解答提示
阴性对照出现阳性结果
试剂 / 样品污染
试剂和样品可能被污染,或者由于孔之间的溅洒交叉污染。使用新鲜试剂,小心操作移液器。 夹心 ELISA - 检测抗体与包被抗体反应
确定使用的是正确的包被抗体和检测抗体 , 他们之间不会互相反应。 酶标板洗板不彻底
用洗液充满板孔确保每孔被充分洗涤,洗板前确保所有的剩余抗体溶液被倒净。 抗体量过多导致非特异结合
根据推荐用量使用抗体。尽量使用较少的抗体。
酶标板整体背景高
结合反应太强或时间过长
检查底物的稀释,使用建议的稀释度。当酶标板显色足够进行吸光度读取时立即用终止液终止反应。 底物溶液或终止液不是新配制
使用新配制的底物溶液。终止液应该是清亮的(如果它变黄,这是被污染的标志,需要重新配制)。 没有终止反应
如果底物反应没有被终止,颜色会继续变化。 酶标板在酶标仪读板前放置时间过长
颜色会继续变化(尽管加了终止液,依然会以很慢的速度变化 )。 试验器皿污染
确保试剂是新配的并且使用的是清洁的玻璃器具。
底物孵育过程没有避光
底物孵育应该在避光条件下进行。 孵育温度过高
抗体在适宜的温度下有最佳的结合活性。确保孵育在正确的温度下进行,孵育箱要设定好适宜的温度并正常工作。孵育温度可能 需要一些优化。
抗体非特异性结合
确保进行了封闭并使用的是恰当的封闭液。我们建议使用 5-10% 的与二抗同种动物来源的血清或牛血清。 确保板孔经过预处理以防止非特异结合。使用亲和力强、纯度高的抗体,最好经过了预吸收。
请检查针对“阴性对照出现阳性结果”的建议
吸光度数值低
使用的样品中没有显示出靶蛋 白或者靶蛋 白显示的水平低
检查靶蛋白表达系统,确保它在您的样品中被表达出来。如果靶蛋白的表达水平低,需要增加样品使用量,或者您可能需要选择 一个更灵敏的测定方法。确保您使用的是没有超出测定方法检测范围的阳性对照。
抗体不足
确定使用的是建议的抗体量,为了使结果更好可能需要增加抗体的浓度。 底物溶液不是新鲜配制或成分有误
使用前新鲜配制底物溶液。确保储备液在有效期内并且被正确储存,使用的浓度也是正确的。确保试剂按正确的浓度使用。
试剂不是新鲜配制或 pH 值有误
确保试剂配制正确并在有效期内。
孵育时间不够长
如果建议了孵育时间,确保按推荐的时间长度孵育抗体。为了使结果更理想,孵育时间可能需要增加。
孵育温度太低
抗体在适宜的温度下有最佳的结合活性,确保孵育是在正确的温度下进行,孵育箱要设定好适宜的温度并正常工作。孵育温度可 能需要一些优化。确保所有的试剂在使用前是室温。
未加终止液
加入终止液可以增加显色反应的强度,也能固定反应最终的颜色。
吸光度数值高
样品和 / 或阳性对照吸光度数值高。吸光度没有按样品在板子上的稀释度递减。
样品或阳性对照的浓度过高,超出了试验方法检测的范围。重新设置试验方法或者在加样前通过稀释降低样品和对照的浓度,在 处理结果计算浓度时考虑到所作的稀释。
酶标板上吸光度不规律
孵育时酶标板叠在一起
酶标板叠在一起使板子每个孔的温度不能平衡一致,请避免堆叠。
吸液不一致
确保移液器使用正确并经过校准、确保枪头插得足够紧密。板子稀释时要特别仔细,注意确保每个枪头都吸上和排出正确量的液 体,这对平行样品结果的一致性有很大影响。
抗体稀释液 / 试剂未混匀
为保证板子所有孔的浓度一致,确保所有的试剂和样品在加到板子上以前都被混合均匀。
板孔变干涸
确保所有孵育期间酶标板始终被盖好。放置一个潮湿的水盘 ( 保持清洁,无菌水 ) 在孵育箱的底部。
洗板不充分
这将导致一些孔没有其他孔清洗的好,残留不同量的未结合的抗体,使后面的结果产生不一致。
酶标板底部不净影响吸光度读取
读板前小心清洁酶标板底部。
