流式细胞术现在是被广泛应用于分析细胞表面和细胞内分子表达水平,从多样性的细胞群中分辨及界定不同的细胞种类,测定分 离出的细胞亚群纯度,以及分析细胞的大小和总量。它可以同时分析单个细胞的多个参数。流式细胞术主要用于检测样本中所发 出的荧光强度。这些荧光是由带有荧光标记用以检测蛋白的抗体,或与特定的细胞分子结合的配体所产生,如与 DNA 结合的溴 化丙啶 (PI) 等。
染色步骤包括:将培养的细胞或组织样品制成单细胞悬液。然后将细胞放入管子或酶标板中与荧光标记或未标记的抗体孵育。最 后将细胞放入流式细胞仪中进行分析。
目录
1. 流式细胞仪:射流系统。
2. 流式细胞仪:检测前向和侧向散射光。
3. 流式细胞仪:检测散射光和荧光。
4. 抗体染色。
5. 选择荧光结合染料。
1. 流式细胞仪:射流系统
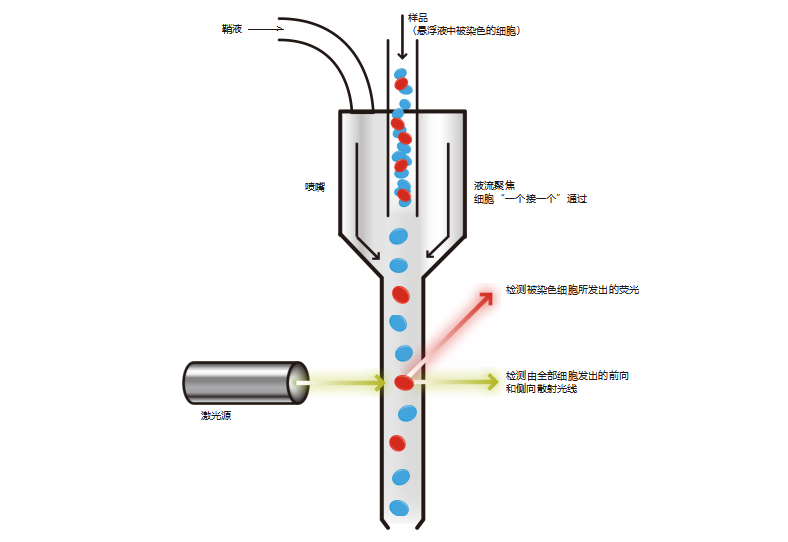
悬浮缓冲液中被染色细胞样品通过流式细胞仪时,由于鞘液的作用,细胞被限制在液流的轴线上,从而能通过一个非常小的喷嘴。 这种微小的“流液束”使细胞一个接一个地通过激光。细胞 / 颗粒通过通道时所散射的光线将被多个检测器检测到。其中光柱前有 一个检测器,称为前向散射 (Forward Scatter,或简称 FS),而光柱的旁边则有几个检测器,称为侧向散射 (Side Scatter,或简 称 SS)。荧光检测器是用作检测 由阳性染色的细胞 / 颗粒散发的荧光。
2. 流式细胞仪:前向和侧向散射光的检测
颗粒 / 细胞通过光束时使光线散射,并通过前向散射 (FS) 和侧向散射 (SS) 而被检测到。散射光和荧光会被检测并一并分析。其中前 向散射与 细胞大小有关,而侧向散射则取决于颗粒 / 细胞的密度(即胞浆颗粒数量、细胞膜尺寸)。因此,透过这种方式,根据细 胞大小和密度通常可 把不同细胞群区分开。
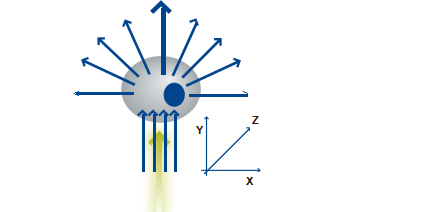
细胞散射的光线方向与以下有关:
• 细胞大小(前向散射;FS)
• 粒度(侧向散射;SS)
下图显示绿色激光照射细胞时的光散射模式:
此技术的一个有用的例子是使用流式细胞仪分析血液样本。
• 侧向散射和前向散射数值都很高的庞大细胞群属较大和较高粒度的粒细胞。
• 单核细胞属形状较大的细胞,但粒度较低,因此其细胞群的前向散射数值高而侧向散射数值低。
• 前向散射较低的独立细胞群属较小的淋巴细胞和淋巴母细胞。它们不是粒状细胞,因此侧向散射也较低。 因此,这些细胞可以根据其前向散射和侧向散射分成不同的细胞群。
.jpg)
3. 流式细胞仪:散射光和荧光的检测
用于对靶蛋白进行检测 / 染色的荧光染料被相应激发波长的激光激发时将发出光线。那些被荧光标记了的颗粒或细胞,可以个别检 测和分析。
自染色细胞发出的前向和侧向散射光及荧光被流式细胞仪内一套滤光片和反光镜分成各个特定的波长并导向。荧光在流式细胞仪内 被过滤,使每个传感器检测的荧光只属某特定波长。这些传感器称为光电倍增管 (PMT)。
PMT 将光子的能量转换成电子信号=电压
.jpg)
例如:
FITC 频道 PMT 检测 FITC 发射大约 519nm 波长的光。(它也检测任何其他荧光色素所发射出相近波长的荧光。)PE 通道 PMT 检测 PE 发射 575nm 波长的光。(每个 PMT 会检测任何其他荧光色素所发射出相近波长的荧光。)
下图展示了流式细胞仪光学器件的一个例子。
.jpg)
.jpg)
2. 随着荧光标记细胞通过光学仪器并被激光照射,发射的光子数量增加,检测到的电压强度也相应增加。
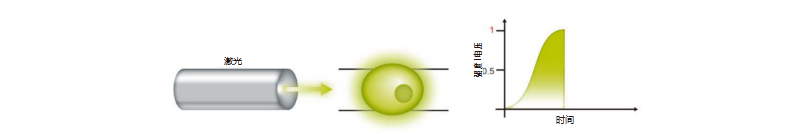
3. 当每个荧光细胞完成通过激光束的路程,随着时间变化会形成一个电压脉冲。总脉冲高度和面积会被流式细胞仪检测。该脉冲 称为一次事件。每次的事件将会具有特定的强度,具体取决于所得脉冲面积。
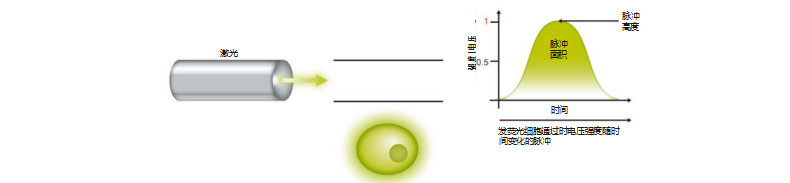
脉冲面积由每个脉冲时间片(取决于 ADC 的速度)的高度值加起来而确定,其中脉冲时间片为 10 兆赫,即每秒 1000 万个脉冲 或每微秒 10 个脉冲。面积更好地代表了荧光总量。
这些事件根据脉冲强度(脉冲面积)而分配通道。 这些信号可以藉调高流过 PMT 的电压而被放大。
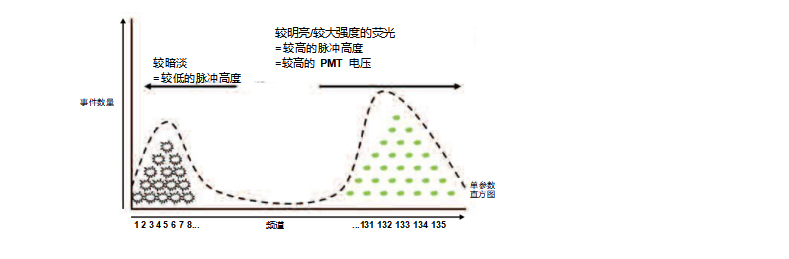
根据其测量强度,每个事件赋予一个频道编号。总共有 1024 个通道。荧光越强,事件分配的频道编号越大。频道编号与事件数 量的曲线图是单参数直方图。通常,这些频道都以对数标度显示在 x 轴上。
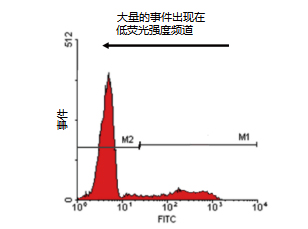
无染色的阴性结果
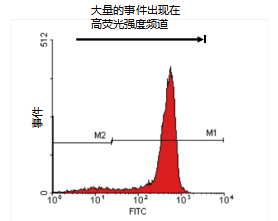
阳性结果
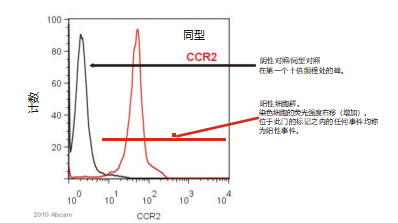
如观察到阴性对照与阳性对照之间信号发生移位,此为阳性结果。例如:ab21667 CCR2 抗人外周血单核细胞 (PBMC) 抗体染色, 设门于单核细胞。
数据:匿名 Abreview
更多有关流式细胞仪的使用和数据分析的信息,请查看我们的流式细胞术实验方案。
4. 抗体染色
直接染色
直接免疫荧光染色时,细胞与直接偶联有荧光染料(如 FITC 标记)的抗体孵育。这种方法的优点在于只需要一步抗体孵育,从而 排除了二抗非特异性结合的可能性。这对细胞内染色特别有用,因为包含二抗的大抗体荧光复合物有可能被困住,造成非特异性 结合甚或无法进入细胞,而使一抗检测不到。
间接染色
间接染色时,一抗是没有标记荧光色素,而是通过带有荧光色素标记的二抗进行检测。这种二抗是对一抗具有特异性的抗体。另 外可选择使用亲和素 - 生物素系统,即使用偶联了生物素的抗体,通过带有荧光标记的亲和素进行检测。随着目前有更多种类的偶 联二抗可以选择,这种方法意味着结合使用一种带有荧光标记的二抗,可配合针对不同目标蛋白而没有连接偶联物的一抗,来进 行流式细胞术的分析。这拓宽了研究者对目标蛋白的选择。
细胞内染色
使用流式细胞技术进行的细胞内源抗原的染色检测成功与否,取决于各种不同的固定和通透方法,以使抗体接近细胞内部蛋白。 任何情况下,要获得成功的染色都必须对实验条件进行优化,包括测定抗体效价,采用合适的对照来正确设定流式细胞仪,并且 优化固定和通透步骤。
检测分泌蛋 白
检测分泌蛋白是相对困难,是由于蛋白在检测前就从细胞中向外分泌或者迅速降解。进行此类实验需要使用高尔基体阻断剂 (Golgi-Block),例如布雷非德菌素 A (Brefaldin A)。细胞与 Brefaldin A 孵育,可以阻止蛋白从高尔基体中释放。任何已表达而 停留在高尔基体内的蛋白,都可以在细胞内被检测,使用细胞内染色方法,便可检测此类目标蛋白。
5. 选择合适的荧光色素偶联物
对一个给定的抗体,能否从阴性信号中分辨出阳性信号,往往取决于所用的荧光色素偶联物。
各种荧光色素相对强度的一般准则是,从最亮到最暗: PE、PE-Cy7、PE-Cy5、APC > APC- Cy7、Alexa Fluor 647、Alexa Fluor 700 > FITC、Pacific Blue、Alexa Fluor 488。这是一般模式。在个别抗体中,这相对强度的模式会有差异。
一个有高表达水平的抗原,几乎使用任何一种荧光色素都能检测出其抗原和从阴性信号中分辨出来。水平较低的抗原或需要配合 使用较亮的 PE 或 APC 这类偶联物来获取高信背比,以便从未染色细胞中充分地分离出阳性细胞。
