一、 交联染色质免疫沉淀 (X-ChIP) 操作步骤

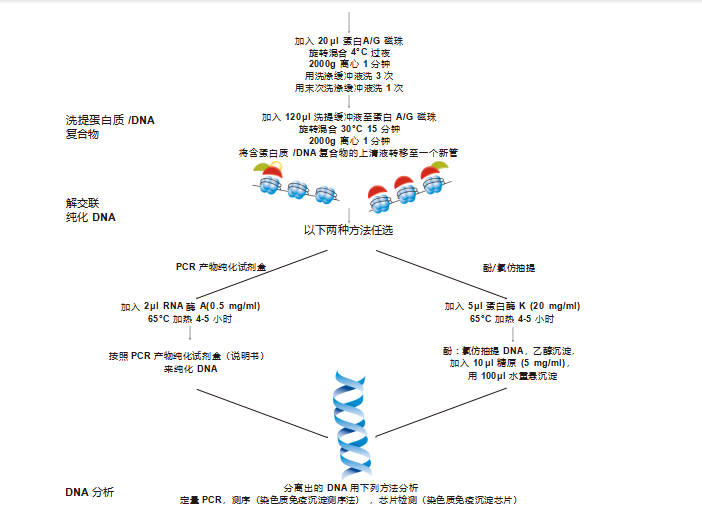
染色质免疫共沉淀是一种强力的手段,来联系蛋白质或其修饰位点与基因组的关系。染色质分离并用特异性抗体判断是否与 特异性 DNA 序列相结合。染色质免疫沉淀法亦可用来检测目的位点在基因组中的时空分布(用芯片或 DNA 测序)。本操作规程 详细阐述了交联染色质免疫沉淀 (X-ChIP) 实验的具体步骤。
1. 交联和细胞收集
|
用甲醛来使蛋白质和 DNA 相交联。交联的时间很关键,因此需优化。建议样本交联的时间为 2-30 分钟。 过度的交联可降低抗原的可结合性和超声的效率。抗原的表位也会被遮盖。甘氨酸可抑制甲醛的作用并终止交联反应。 |
1.1 取 2 个 150cm2 培养皿的融合细胞 ( 每皿细胞数约 1 X 107 - 5 X 107 个 )。向培养基中滴加甲醛以使蛋白和 DNA 相交联,甲醛的 终浓度为 0.75%(体积百分比),室温下轻轻摇动 10 分钟。
1.2 加入甘氨酸至终浓度为 125mM,轻轻振荡孵育 5 分钟。
1.3 用 10ml 冷 PBS 洗涤细胞 2 次。
1.4 刮下细胞并用 5ml 冷 PBS 收集,转移至一个 50ml 离心管中。
1.5 用 3ml PBS 洗涤培养皿,收集剩余细胞至 50ml 离心管中。
1.6 1000g 离心 5 分钟
1.7 小心吸弃上清液,用 FA 裂解缓冲液重悬沉淀 ( 每 1 X 107 个细胞加 750μl)
|
用细胞悬液实验时,起始细胞量为 1x107- 5x107 个细胞,并按照第一部分的步骤加入体积百分比 0.75% 的甲醛和甘氨酸。 离心沉淀细胞(5 分钟, 1000g)。用冷 PBS 洗涤 3 次,用 FA 裂解液重悬沉淀(每 1 X 107 个细胞加 750μl)。然后转到步骤 2.1。 |
2. 超声
|
当使用组织来进行实验时(见步骤 6.2),要得到单细胞悬液,应从此步超声处理开始。 |
2.1 将裂解液超声处理以使 DNA 断裂成约 500-1000bp 的片段。不同的细胞系需要不同的超声时间,因此需分别进行优化。
|
交联后的裂解液应进行超声处理,并优化得到最佳条件。取部分样本按照步骤 3 进行 DNA 分离。 片段大小应按照图 1 所示,用质量百分比 1.5% 的琼脂糖凝胶分析。 |
2.2 超声处理后,4°C ,8000g 离心 30 秒使细胞碎片沉淀。将上清液转移到新管中。此染色质溶液将用于步骤 4 的免疫沉淀(IP)。
2.3 每个超声后的样本均取 50μl,此样本为抽样样本,用于定量 DNA 浓度(见步骤 3),并作为 PCR 的对照样本。
|
超声后的染色质可在液氮中速冻,在 -80°C 中可保存 2 个月。应避免反复冻融。 |
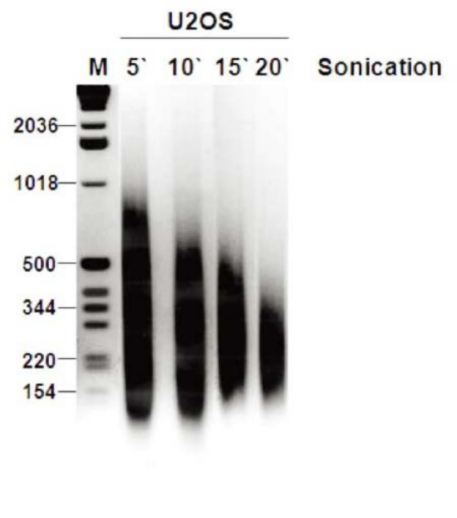
图 1. U2OS 细胞分别超声 5、10、15 和 20 分钟。随时间的延长,所得片段大小逐渐减少。超声 15 分钟后可得到最适片段大小。 注意:超声时间过长会使核小体与 DNA 的交联断裂,因此条带大小不应低于 200bp。
3. DNA 浓度测定
3.1 抽样样本用来测定 DNA 浓度,为后续 IP 反应提供数据。用 PCR 产物纯化试剂盒(加 70μl 洗提缓冲液,转至步骤 3.2a)或酚: 氯仿(加 350μl 洗提缓冲液,转至步骤 3.2b)来纯化 DNA。
3.2a 加入 2 μl RNA 酶 A (0.5 mg/ml)。置于 65°C 恒温振荡 4-5 小时(或过夜)以解交联。按照 PCR 产物纯化试剂盒说明书来纯 化 DNA。
|
用 DNA 纯化试剂盒来纯化 DNA 时,RNA 浓度过高会干扰 DNA 的纯化过程,因此样本中应加入 RNA 酶 A 处理。 否则纯化柱吸附饱和时产物会大大减少。 |
3.2b 加入 5μl 蛋白酶 K (20mg/ml)。65°C 恒温振荡 4-5 小时(或过夜)以解交联。酚:氯仿抽提 DNA,乙醇沉淀中加入 10μl 糖原 (5 mg/ml)。
用 100μl 水重悬沉淀。样本可冻存于 -20°C 冰箱中。
|
样本用蛋白酶 K 处理,可使脂肪与芳香族氨基酸的羧基邻近的肽键断裂。破坏蛋白质和 DNA 的交联可帮助 DNA 的纯化。 |
3.3 DNA 浓度测定:取 5μl 纯化 DNA,加入装有 995μlTE 的离心管中,200 倍稀释,测定 OD260。根据公式 DNA 浓度(μg/ml)= OD260 x
10,000,计算每毫升染色质溶液中 DNA 的浓度。
4. 免疫沉淀
4.1 使用步骤 2.2 中得到的染色质溶液继续此操作。建议每个免疫沉淀反应 DNA 含量约为 25μg。每个样本用 RIPA 缓冲液 1:10 稀释。 应设一个抗体对照和一个仅加磁珠的对照。
4.2 除对照外,其余样本中均加入一抗。事先应通过预实验得到最佳的抗体加入量。一般来说,每 25μg DNA 加入 1-10μg 抗体。
4.3 所有样本均加入 20μl 的蛋白 A/G 磁珠(预吸附了鲑鱼精 DNA 和牛血清白蛋白,见步骤 4.3a),进行免疫沉淀反应,4°C 旋转过夜。
4.3a 蛋白 A/G 磁珠与鲑鱼精 DNA 混合液的制备:如果使用蛋白A 和蛋白 G 两种磁珠,应将其等体积混合,并用 RIPA 缓冲液洗 涤 3 次。
吸弃 RIPA 缓冲液,加入鲑鱼精 DNA 至终浓度 75ng/μl,同时加入牛血清白蛋白至终浓度 0.1μg/μl。加入等体积 RIPA 缓冲液, 常温旋转孵育 30 分钟。用 RIPA 缓冲液洗涤一次,然后加入等体积 RIPA 缓冲液。
|
应使用蛋白 A 磁珠、蛋白G 磁珠或两种混合物。61 页第 9.5 部分的表中列出了两种磁珠对不同种属免疫球蛋白的不同亲和性。 |
4.4 将蛋白 A/G 磁珠离心,2000g 1 分钟,弃上清。
4.5 用 1ml 洗涤缓冲液洗涤磁珠 3 次。2000g 离心 1 分钟。
4.6 用末次洗涤缓冲液洗 1 次。2000g 离心 1 分钟。
|
如果背景过高,则应增加洗涤次数。或者,在步骤 4.2 之前将超声处理后的染色质与蛋白A/G 磁珠共孵育 1 小时,以去除背景。 此步将消除与磁珠的非特异行结合。将上清液(超声处理的染色质)转移至一个新管中,然后按照前述步骤 4.2 将抗体与磁珠孵育。 |
5. 洗涤和解交联
5.1 洗涤 DNA:向蛋白 A/G 磁珠中加入 120μl 洗涤缓冲液,30°C 旋转 15 分钟。
5.2 2000g 离心 1 分钟。将上清液转移至新管中。样本可于 -20°C 保存。
5.3 纯化 DNA 可用 PCR 纯化试剂盒(见步骤 3.2a)或酚 : 氯仿(加 280μl 洗提缓冲液,然后参照步骤 3.2b)法进行。
5.4 DNA 可用实时 PCR 进行定量检测。可用实时 PCR 仪自带的软件进行引物和探针设计。或者,也可以使用在线设计工具进行 设计。
6. 组织免疫沉淀中染色质的制备
此步骤描述了从组织中制备染色质,以用于后续的染色质免疫沉淀反应。每个免疫沉淀 / 抗体反应推荐使用组织 30mg,但 组织使用量可根据实际进行调整。每种组织的用量依据组织蛋白丰度、抗体亲和力和交联效率而定。每个免疫沉淀反应最适染色质 的量为 5-15μg。每次交联免疫沉淀反应之前,需根据不同组织类型确定具体的染色质需要量。应先按照下述方法制备染色质溶液, 再进行交联免疫沉淀反应。所有溶液中均应添加蛋白酶抑制剂(10μl/ml 的 PMSF,1μl/ml 的抑肽酶和 1μl/ml 的亮肽素,溶于 PBS 中)。
本部分摘自 Henriette O’ Geen,Luis G.Acevedo 和 Peggy J. Farnham 提供的操作规程。
6.1 交联
|
冰冻组织应置于冰上融化(根据组织用量的不同,此过程可能需要几个小时不等)。注意,冰冻组织融化时温度不能过高, 以免蛋白酶活化使组织降解。操作过程中样本要一直置于冰上,所有操作均应迅速完成,以使其处于融化状态的时间最短。 组织切块时要在培养皿中进行,其下要放置一块干冰。 |
6.1.1 用刀片将冰冻或新鲜组织切成小块(1-3mm3)
6.1.2 取一个空的 15ml 锥形离心管,称重,放入组织后再次称重,计算组织重量。
6.1.3 在通风橱中配制交联所用溶液。每克组织加 10ml 磷酸盐缓冲液。加入终溶度 1.5%(v/v)的甲醛,室温旋转 15 分钟。
6.1.4 加入甘氨酸至终浓度 0.125M,以终止交联反应。继续室温旋转 5 分钟。
6.1.5 组织样本离心,4°C 720 rpm,离心 5 分钟。
6.1.6 吸弃培养基,用 10ml 冰上预冷的 PBS 洗涤。4°C 720 rpm,离心 5 分钟,弃掉洗涤缓冲液。
此步所得组织可以用液氮速冻,然后保存于 -80°C。应避免反复冻融。 如果随后使用,可以用冷 PBS 重悬组织,每克组织加 10ml,冰上放置。
6.2 组织降解
应用 Becton Dickinson 生产的 Medimachine(中型研磨器)处理得到单细胞悬液。每克组织使用 2 个中号锥形研磨管 (50μm)。
6.2.1 将 1ml 枪头的末端剪掉,使吸头口增大。
6.2.2 50-100mg(3-4 块)的组织用 1ml PBS 重悬。
6.2.3 将溶液加入锥形研磨管中,研磨 2 分钟。
6.2.4 将 18 号钝圆的针头连接到 1ml 注射器上,将其插入锥形研磨管中收集细胞。将细胞加入一个锥形管中,冰上放置。
6.2.5 重复步骤 2.2 直到所有组织均处理完。
6.2.6 镜下观察细胞悬液,以确定得到的是单细胞悬液。如果需要进一步研磨,可在组织中加入更多的 PBS,重复步骤 2.2 到 2.5 直至 所有组织均研磨成均一的悬液。
6.2.7 将细胞离心,1000rpm,4°C,离心 10 分钟。估算细胞沉淀的体积以备下一步操作。
6.2.8 小心吸弃上清液,用 FA 裂解缓冲液重悬沉淀(每 1x107 个细胞加入 750μl)。
6.2.9 从第 2 阶段(超声处理)开始,继续进行交联染色质免疫沉淀反应。
二、ChIP 疑难解答提示
无特异性抗体对照时出现背景过高
与蛋 白 A 或 G 非特异性结合
应采用预清除处理,即在加入抗体前,将裂解的样本与磁珠混合 1 小时然后分离使用。
染色质免疫沉淀所用缓冲液被污染 裂解液和洗涤缓冲液要新鲜配制。
某些蛋 白 A 或 G 磁珠本身会产生很高的背景
某些蛋白 A 或 G 磁珠会有很高的背景。要找到一个合适的供应商,所提供的产品应在非特异性对照样本中得到背景最低最干净的结果。
结合区域过大使得背景过高分辨率过低
片段过大
针对不同的细胞系,应优化 DNA 片段的大小。超声时间和酶孵育时间均应调整。建议 DNA 片段不要超过 1.5kbp。如果用酶消化染 色质,会得到 175bp 大小的单核苷酸酶。
信号过低
染色质片段过小
要得到小于 500bp 的染色质片段时,不需进行超声处理。太小的片段会使核小体被误认为核小体间的 DNA 而被消化掉。如果进行 末端染色质免疫沉淀,通常酶消化法即能得到所需大小的染色质片段。
交联染色质免疫沉淀时交联时间过长
用甲醛交联 10-15 分钟,然后用磷酸盐缓冲液洗净,接着需要加入甘氨酸以终止甲醛的作用。过度交联可能会降低表位的可结合度从 而减少抗体的结合。
原材料不足
建议每个免疫沉淀反应用 25μg 染色质
免疫沉淀中抗体不足
建议开始时加入抗体量为 3-5μg。如果未检测到信号,可增加抗体量至 10μg。
特异性抗体结合受阻碍
在洗涤缓冲液里氯化钠浓度不要高于 500mM,否则浓度过高将阻碍特异性抗体结合
细胞裂解不充分
建议用 RIPA 缓冲液来裂解细胞
目标区域无足够的抗体
目标区域无表位。应有阳性对照抗体,以确认操作过程无误,如 H3K4me3 用于活化的启动子,或者 H3K9me3 抗体用于异染色质 位点。
有些单抗不适合做交联染色质免疫沉淀
单抗识别的表位可能会在交联过程中被掩盖,而阻碍位点识别。建议用多克隆抗体,可识别多个表位,这样就增加了免疫沉淀目标 蛋白的几率。
用错了抗体亲和性磁珠
蛋白 A 和 G 是细菌来源蛋白质,其对不同种的免疫球蛋白的亲和性不同。请使用特异性的亲和基质。建议使用混合好的蛋白A 和 蛋白 G 琼脂糖。
免疫沉淀 DNA 时 PCR 扩增的问题
反应后包括无模板的阴性对照在内均出现很高的信号实时 PCR 所用试剂被污染。建议使用储备液来新鲜配制溶液。
样本中无 DNA 扩增
使用标准对照 / 抽样 DNA 以确定样本中引物均有效。
